
ВЕТЕРИНАРНЫМ СПЕЦИАЛИСТАМ.
Задать вопрос президенту НАВНУ
К.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
E-mail: vetnefro@mail.ru
Введение.
Различные хронические гломерулопатии (ГП) и гломерулонефриты (ГН) являются распространенной причиной развития хронической почечной недостаточности (ХПН) и хронической болезни почек (ХБП) у собак и кошек во всем мире. Причем именно кошки, в силу различных и не до конца понятных причин, страдают этими нефропатиями гораздо чаще, чем собаки.
ГП и ГН – группа морфологически разнородных, иммуновоспалительных заболеваний почек первоначально характеризующиеся преимущественным поражением клубочков с последующим активным вовлечением в патологический процесс и других почечных структур.
Причем сегодня тубулоинтерстициальному компоненту в прогрессировании ГП и ГН отводят куда более значимую роль, чем это делалось ранее. До недавнего времени считалось, что именно патологическим изменениям в клубочках и связанных с ними снижением скорости клубочковой фильтрации (СКФ), принадлежит ведущая роль в нарастании протеинурии, снижении плотности мочи, прогрессировании процессов нефросклероза и ХПН. Но в последние годы появляется все больше работ, в которых убедительно доказывается, что при ГП и ГН прогрессирование почечной недостаточности (ПН) связано как с выраженностью гломерулосклероза, так и со степенью тяжести тубулоинтерстициальных изменений . И как считает ряд авторов, именно они в большей степени определяют скорость прогрессирования ПН и выход ГП и ГН в ХБП (17,18, 19, 20). И если смотреть на патогенез нефропатий именно с этих позиций, то становится понятна недостаточная эффективность нефропротективной терапии, имеющей преимущественно гломерулярный тропизм (дилатация афферентных и эфферентных артериол, блокада РААС и т.д.) и делает очень перспективной дальнейшую работу над препаратами, тормозящими процессы склерозирования, в каких бы участках нефрона или интерстиция почки они не происходили (1-15).
ГН и ГП у кошек и собак в подавляющем числе случаев имеют хроническое течение, и от момента появления первых морфологических изменений в клубочках (обнаруживаемых при помощи электронной микроскопии и биологических методов) и характеризующихся микроальбуминурией, до развития терминальной почечной недостаточности и смерти пациента (весь этот непрерывный процесс называется почечным континуумом) обычно проходят годы.
В классификации нефропатий, сопровождающихся первичным поражением гломерул, нет четкого разделения между ГП и ГН. Часть авторов указывает на то, что ГП это более общее понятие, чем ГН, и обозначает любую патологию клубочков. Но с другой стороны многие процессы, приводящие к склерозу (фиброзу), а значит и гибели гломерул, имеют в своей основе процессы, которые воспалительными назвать можно лишь с большой натяжкой .
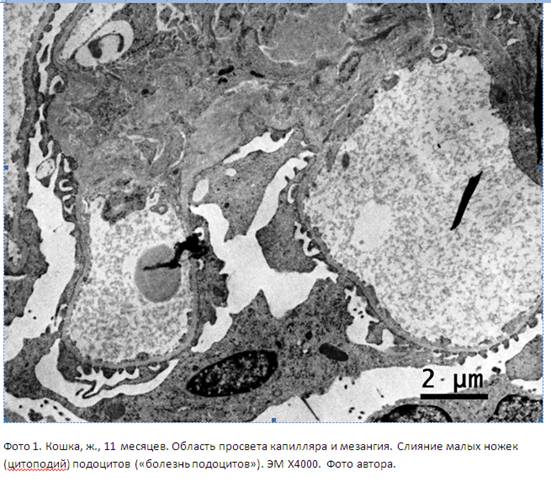
Поэтому в случае, когда патологический процесс не имеет воспалительного компонента, возможно, более верно употребить термин невоспалительные ГП (например, мембранозная нефропатия и липоидный нефроз или «болезнь подоцитов» (фото 1)), а в случае, когда процесс сопряжен хотя бы с несколькими формальными признаками воспалительной реакции (пролиферация и гипертрофия клеток клубочка, интра- и/или перигломерулярная инфильтрация агранулоциами и т.д.) логичнее употребить термин ГН (схема 1).
Классификация ГП и ГН у собак и кошек.
«Современная нефрология началась знаменитыми трудами R. Bright, который установил связь между водянкой и определенными морфологическими изменениями в почках» (16). Случилось это в середине XIX века. С тех пор классификация различных заболеваний почек у человека и животных, а в особенности ГН неоднократно пересматривалась и дополнялась в связи с появлением новых клинических и морфологических данных. Единой классификации, удовлетворяющей требованиям клиницистов различных специальностей, трансплантологов и морфологов, нет до сих пор.
В данной статье будет предпринята попытка синтеза различных классификаций ГП и ГН (таблица 1-1 и таблица 1-2) таким образом, чтобы помочь врачу общей практики:
- в понимании механизмов возникновения и развития ГП и ГН;
- в постановке корректного нефрологического диагноза не инвазивными и инвазивными методами;
- в назначении комплексного лечения на всех этапах почечного континуума;
Традиционно классификация ГН подразделяют на этиологическую (по происхождению), патогенетическую (иммунологическую) и морфологическую (основанную на типах изменения в клубочках и почечной паренхиме при исследовании их методами световой и электронной микроскопии).
Этиологическая классификация ГП и ГН у собак и кошек.
Основной сложностью в лечении хронических поражений почечной паренхимы является то, что подавляющую часть времени они протекают без каких-либо клинических проявлений и остаются незамеченными не только владельцами животных, но зачастую и лечащими врачами. Первые признаки неблагополучия можно выявить сначала в моче (микроальбуминурия, подоцитурия, дисбаланс между воспалительными и противовоспалительными факторами тканей почек ; позже - макропротенурия, уменьшение плотности мочи) и по снижению скорости клубочковой фильтрации (СКФ), затем в сыворотке крови (азотемия легкой, а иногда и средней степени). И только после этого, когда общая масса форменных элементов почки утрачена более чем на 65-75 %, лавинообразно начинают появляться различные клинические проявления нефропатий. Это финальная стадия в этиопатогенезе хронических нефропатий, на которой значительно снижается способность почек выполнять не только свои экскреторные и метаболические, но и эндокринные (секреция эритропоэтина, кальцитриола и фермента ренина) функции.
Этим обстоятельством объясняется большое разнообразие и неспецифичность, как клинических проявлений хронических нефропатий на финальном этапе почечного континуума, так и сложность их лечения. Именно поэтому диагностика хронических нефропатий должна осуществляться задолго до появления первых признаков почечной недостаточности (ПН), когда корректно подобранное этиотропное и патогенетическое (ренопротективное) их лечение не только возможно, но и высокоэффективно, и может значимо замедлить скорость прогрессирования нефросклероза. Тем более, что к моменту появления у пациента ХПН II-IV степени (по классификации IRIS) тубулоинтерстициальный компонент ГН если и не преобладает над гломерулярным, то по крайне мере равен ему, и приводит к неминуемому прогрессированию ХБП, даже несмотря на нефропротективную терапию (17,18, 19, 20) .
Факторы сенсибилизации.
Ключевым моментом этиологической классификации ГП и ГН является выявление эндогенных или экзогенных АГ (пусковых агентов), инициирующих каскад иммунологических реакций, приводящих, в конечном итоге, к поражению гломерул.
Учитывая то обстоятельство, что ГП и ГН начинают развивается спустя недели или даже месяцы после воздействия АГ (а диагностируется и того позже), то их первоначальную причину (фактор сенсибилизации) у конкретного пациента установить сложно или невозможно. Поэтому, чаще всего клиницисты вынуждены относить ГП и ГН к идиопатическим заболеваниям.
A. Plotnick (2008) указывает на роль некоторых экзогенных и эндогенных АГ как вероятных этиотропных факторов в развитии ГП и ГН (таблица 2).
Таблица 2. Возможные этиологические факторы (факторы сенсибилизации) ГП и ГН.
|
Инфекционные |
Неинфекционные |
Особые |
|
- Вирусные инфекции: ВЛК, ВИК, коронавирус (у кошек); - Бактериальные инфекции (дерматиты, пиометра, гингивит, эндокардит и т.д.); - Грибковые инфекции; - Боррелиз; - Бруцеллез; - Паразитарные инфекции; |
- Ятрогенния (нефротоксичные лекарственные препараты ); - Сыворотки и вакцины; - Различные яды; - Соли тяжелых металлов; |
- Радиоактивное излучение; - Наследственные причины (наследственные ГН и ГП); |
Вероятно, одним из ведущих этиологических факторов ГП и ГН у кошек являются различные малопатогенные и маловирулентные вирусы (подобные вирусу герпеса у человека), длительно, или даже пожизненно, персистирующие в организме большинства животных (латентные и хронические инфекции). Такой полиморфизм факторов сенсибилизации является одной из причин объясняющей более высокую распространенность ГП и ГН среди кошек, чем среди собак (21).
Также немаловажно, что у человека, например, постинфекционный ГН развивается спустя две-три недели после перенесенного бактериального заболевания (стрептококковой или стафилококковой инфекции) на фоне практически полной элиминации АГ возбудителя из организма и обычно имеет острое течение, что облегчает постановку клинического диагноза уже на этапе сбора анамнеза.
У собак и кошек форм ГП и ГН, которые могли бы характеризоваться острым началом (гипертермия и стремительное развитие острой почечной недостаточности), практически нет. У них не часто диагностируют ГП и ГН даже на доклинической или неазотемической стадии, не говоря уже об этапе дебюта заболевания.
У кошек же вирусиндуцированный ГН, скорее всего, развивается под продолжительным (чаще пожизненным) прессингом со стороны различных вирусных АГ. Особенно это касается кошек, содержащихся группами, где идет постоянный обмен микрофлорой. Естественным следствием этого является постоянное присутствие в кровотоке различных АГ, нейтрализация которых приводит к образованию циркулирующих иммунных комплексов (ЦИКи) АТ+АГ+С3 (антиген + антитело + компонент комплимента) с фильтрацией и осаждением их в клубочках (это наиболее вероятный, но далеко не единственный вариант развития ГН).
Возможно, в связи с этим именно у кошек наиболее часто диагностируют ХБП, развившуюся как следствие хронического течения ГП и ГН (21).
Выявление же этиологических факторов возникновения ГН и ГП у собак и кошек очень важно для:
- предотвращения возникновения заболевания у еще не болеющих животных;
- для снижения уровня заболеваемости в популяциях в целом.
Для уже болеющих ГН животных (особенно на стадии сопровождающейся ХПН), этиологический фактор возникновения заболевания чаще всего не известен и, как правило, не актуален.
Почему ГП и ГН чаще болеют именно кошки?
Теории и гипотезы.
• Большое число видоспецифичных для кошачьих вирусных инфекций, имеющих хронические или латентные формы течения.
• Содержание кошек группами, в которых происходит постоянный обмен вирусными агентами, инициирующими в организме каскад иммунных реакций, одним из итогов которых является образование иммунных комплексов.
• Недостаточно эффективная элиминация иммунных комплексов через микрокапиллярную сеть гломерул, возможно в силу физиологических «дефектов/особенностей» этого вида животных.
• Ограниченный выбор эффективных противовирусных препаратов.
• Отсутствие широкого распространения во врачебной практике назначения нефропротективных препаратов кошкам, болеющим или переболевших острыми (подострыми) формами вирусных инфекций.
• Особенности белкового обмена у облигатных хищников, возможно имеющие негативное влияние на функцию почек (особенно на микрофильтрацию в гломерулах).
Типы иммунного повреждения.
Патогенетическая (иммунологическая) классификация.
Выделяют неиммунное и иммуноопосредованное (аутоиммунное) воспаление клубочков (таблица 3).
ГП неиммунного происхождения или вторичные ГП в большинстве случаев является сопутствующим заболеванием (например, при сахарном диабете или заболеваниях щитовидной железы). Также не исключено и прямое воздействие патогенов на клетки почки.
Иммуноопосредованное воспаление наиболее часто развивается по иммунокомплексному и антительному типам.
Механизм развития иммунокомплексного ГН следующий. ЦИКи (АГ+АТ+С3), образующиеся вследствие нейтрализации различных патогенов или их АГ, прикрепляются к эндотелию сосудов в тканях почек, фагоцитируются и элиминируются через клубочковый фильтр. Задерживаясь в фильтрационном барьере клубочка, ЦИК накапливаются на стенках капилляров, в конечном итоге вызывая повреждение эндотелия сосудов и нарушение микроциркуляции в петлях клубочка. ЦИК помимо прочего активируют ряд факторов свертывания крови и агрегацию тромбоцитов. Результатом гиперкоагуляции являются микротромбозы, что приводит к микронекрозам, которые вызывают реактивное асептическое воспаление (в нем активное участие принимают агранулоциты, «управляемые» провоспалительными цитокинами) как заключительный этап заболевания.
При ГН с антительным механизмом источником антигенемии является сама базальная мембрана капиллярных петель клубочка, поврежденная ранее каким-либо образом (в том числе и при участии ЦИК или, возможно, различных патогенов). АТ вырабатываются непосредственно против базальной мембраны (это очень часто наследственная патология) или АГ, зафиксированных на ней.
Но по какому бы механизму ни развивался патологический процесс, итогом его у собак и, особенно кошек, почти всегда является хронический ГН с выраженным тубулярным или тубулоинтерстициальным компонентом. И интересно, что в каждом конкретном случае в патологических реакциях могут участвовать различные звенья и факторы иммунного ответа (в т.ч. медиаторы воспаления, провоспалительные цитокины и т.д.) и системы свертывания крови. От всего множества сочетаний повреждающих факторов и противостоящих им механизмов самозащиты почки и зависит начальный гистологический (морфологический) тип повреждения клубочков при ГП и ГН.
Таблица 3. Патогенез ГН и ГП у собак и кошек.
|
Механизмы повреждения клубочков |
Частота встречаемости |
Механизм иммунного повреждения |
|
Иммунные |
Часто |
Отложение иммунных комплексов АГ+АТ+С3 с последующим асептическим воспалением. |
|
Редко |
Прямое действие нефротоксических антител на базальную мембрану или АГ-нам, прикрепленным к ней с последующим асептическим воспалением. |
|
|
Неиммунные |
- Непосредственное проникновение вирусов в клетки почки (возможно, исследовано недостаточно). - Вторичные нефропатии. |
|
Морфологическая классификация ГН и ГП.
Морфологическая классификация основывается на типе реакции клубочка на повреждение (например, пролиферация, утолщение мембраны и т.д.). Гистологическая картина помогает в определении этиологии заболевания и выборе терапевтической тактики у каждого конкретного пациента. Определение морфологической формы ГП и ГН на сегодняшний день является практически единственным способом постановки окончательных диагнозов в нефрологии и осуществляется после изучения гистоматериала, полученного путем пункционной нефробиопсии (24). Диагноз, выставленный по результатам неинвазивных методов исследования (анализы биологических жидкостей, визуальные методы), в большинстве случаев является клиническим или предварительным и обычно позволяет лишь предположить нозологическую форму заболевания. Исключения составляют нефропатии, характеризующиеся яркими макроскопическими изменениями (поликистоз), неоплазии почек , или если бактериологическими методами подтверждена их инфекционная природа (пионефроз, пиелонефрит).
C другой стороны, сегодня стало очевидным, что прогрессирование любых хронических нефропатий гломерулярного и тубулоинтерстициального ряда у собак и кошек, независимо от их природы и пусковых механизмов, обусловлено действием совокупности одних и тех же клеточных и молекулярных механизмов. Эти механизмы, с точки зрения патогенеза, представляют собой совокупность процессов, направленных на восстановление тканей почки в ответ на их повреждение и гипоксию (22,23). Но для почки, как органа, эти процессы репарации носят фатальный характер, поскольку в конечном счете приводят к склерозированию ее форменных элементов, стромы и потере способности выполнять свои экскреторные и эндокринные функции. Именно поэтому на заключительных этапах почечного континуума, характеризующихся азотемией или уремией, гистоморфологическая картина обычно представляет собой сочетание хотя и ярко выраженных, но однотипных изменений в корковом и мозговом слое, и не позволяет точно определить начальную нозологическую форму ГП или ГН. Тем более, что к этому моменту поражение гломерул, канальцев и интерстиция вносят в целом соизмеримую лепту в процессы поражения почечной паренхимы и прогрессирование ХПН. На этом этапе, возможно, более верно производить оценку степени тяжести хронических ГП и ГН (легкая, средняя, тяжелая) на основании ряда ключевых морфологических изменений в клубочках и корковом слое почек (таблица 4).
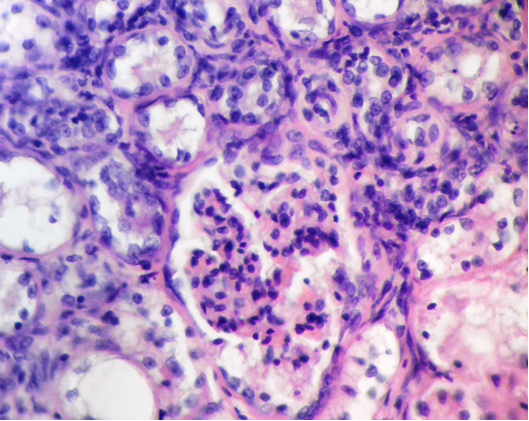
Фото 2. Кошка ж. 12 лет. Корковый слой почки. Долчатость гломерулы. Интра- и перегломерулярная, интро- и перитубулярная инфильтрация агранулоцитами. Дистрофия и атрофия высокого цилиндрического эпителия проксимальных канальцев. Гематоксиллин-эозин х400. Фото автора.
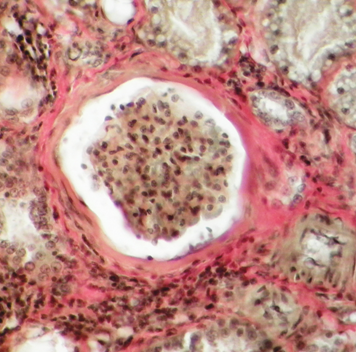
Фото 3. Кошка ж. 12 лет. Корковый слой почки. Гиперклеточность и глобальный склероз гломерулы. Интра- и перегломерулярная, интро- и перитубулярная инфильтрация агранулоцитами. Дистрофия и атрофия высокого цилиндрического эпителия проксимальных канальцев. Склероз капсулы Боумена и интерстиция. Ван-Гизон х400. Фото автора.
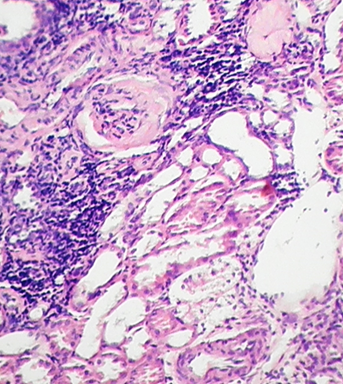
Фото 4. Кошка, ж. 18 лет. Корковый слой почки. Глобальный склероз клубочков. Перегломерулярная, интро- и перитубулярная инфильтрация агранулоцитами. Дистрофия и атрофия высокого цилиндрического эпителия проксимальных канальцев. Расширение канальцев. Гиалиновые цилиндры в просвете проксимальных канальцев. Клинический диагноз – уремическая (IV степень по классификации IRIS) стадия ХБП. Гистоморфологический диагноз - тяжелая степень хронического ГН с выраженным тубулоинтерстициальным компонентом («почечная катастрофа»). Гематоксиллин-эозин х100. Фото автора.
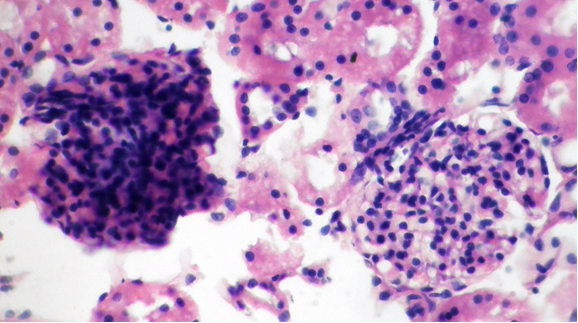
Фото 5. Кошка ж., 7 лет. Корковый слой почки. Различная степень гиперклеточности гломерул . Гематоксилин-эозин. х400. Фото автора.
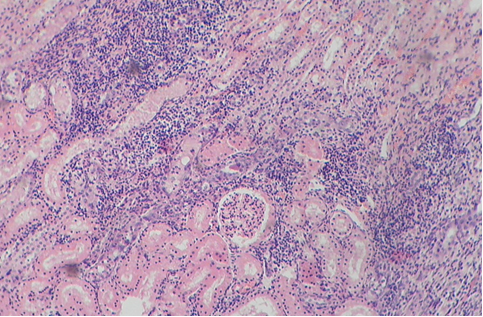
Фото 6. Кошка ж., 1 год. Корковый слой почки. Диффузная инфильтрация коркового слоя агранулоцитами. Дистрофия и атрофия высокого цилиндрического эпителия канальцев. Гематоксилин-эозин х40. Фото автора.
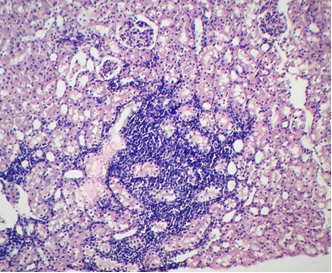
Фото 7. Кошка ж., 7 лет. Корковый слой почки. Очаговая инфильтрация коркового слоя почки агранулоцитами. Гематоксилин-эозин х40. Фото автора.
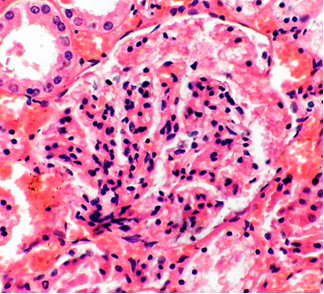
Фото 8. Кошка, ж., 15 лет. Корковый слой почки. Расслоение петель гломерулы («лапчатость»). Клеточно- белковые депозиты сегментарного вида («полулуния») в капсуле Боумена (начальный этап процесса). Гематоксилин-эозин х400. Фото автора.
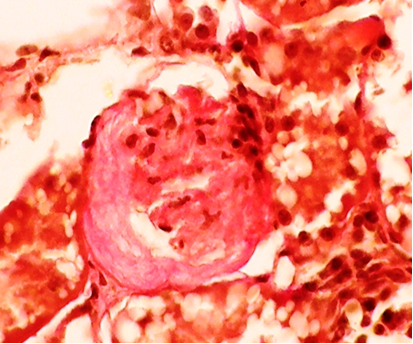
Фото 9. Кошка, м., 18 лет. Корковый слой почки. Глобальный (полный) склероз клубочка. «Полулуние» в капсуле Боумена (конечная стадия процесса). Ван-Гизон х400. Фото автора.
Литература.
1. Arend W.P. Interleukin-1 receptor antagonist: A new member of the interleukin-1 family. J Clin Invest 1991;88:1445–1451.
2. Tam F.W.K, Smith J., Cashman S.J. et al. Glomerular expression of interleukin receptor antagonist and interleukin-1β genes in antibody-mediated glomerulonephritis. Am J Pathol 1994;145:126–136.
3. Arene W.P., Welgus H.G., Thompson R.C. et al. Biologic properties of recombinant human monocyte-derivated interleukin-1 receptor antagonist. J Clin Invest 1990;85:1694–1697.
4. Chen A., Sheu L.F., Chou W.Y. et al. Interleukin-1 receptor antagonist modulates the progression of a spontaneously occurring IgA nephropaty in mice. Am J Kidney Dis 1997;30(5):693–702.
5. Nikolic-Paterson D.J., Lan H.Y., Hill P.A. et al. Supression of experimentalglomerulonephritis by the interleukin-1 receptor antagonist: Inhibition of intercellular adhesion molecule-1 expression. J Am Soc Nephrol 1994; 4:1695–1700.
6. Visse R., Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function and biochemistry. Circ Res 2003; 92:827–839.
7. Wojtovicz-Praga S.M., Dickson R.M., Hawkins M.J. et al. Matrix metalloproteinases inhibitors. Invest New Drugs 1997;15:61–75.
8. Marti H.P. Role of matrix metalloproteinases in the progression of renal lesion.Press Med 2000;29:811–817.
9. Бобкова И.Н., Козловская Л.В., Ли О.А. Матриксные металлопротеиназы в патогенезе острых и хронических заболеваний почек // Нефрология и диализ 2008. № 2(10). C. 105–111.
10. Asadullah K., Sterry W., Volk H.D. Interleukin-10 therapy – review of a new approach. Pharmacol Rev 2003;55:241–269.
11. Fouquerbay B., Boutard V., Phillipe C. et al. Mesangial cell-derived interleukin-10 modulates mesangial cell response to lipipolysaccharide. Am J Pathol 1995;147:176–182.
12. Stenvinkel P., Ketteler M., Jonson J.R. et al. IL-10, Il-6 and TNF-α: Central factors in the altered cytokine network of uremia – The good, the bad, and the ugly. Kidney Int 2005;67:1216–1233.
13. Tipping P.G., Kitching A.R., Huang X.R. et al. Immune modulation with interleukin-4 and interleukin-10 prevent crescent formation and glomerular injury in experimental glomerulonephritis. Eur J Immunol 1997;27:530–537.
14. Kitching A.R., Katerelos M., Mudge S.J. et al. Interleukin-10 inhibits experimental mesangial proliferative glomerulonephritis. Clin Exp Immunol 2002;128:36–43.
15. Jennette J.C., Olson J.L., Schwartz M.M., Silva F.G. Pathology of the Kidney. - In 2 vol. L.- Williams & Wilkins, 2006.- 1600 p
16. Шулутко Б.И. Патология почек (клинико-морфологическое исследование). – Л.: Медицина, 1983
17. Guseppe D Amiko. Tubulointerstitium as prediktor of progression of Glomerular Diseases. Nefron 1999; 83 (4): 289-295.
18. Hruby Z., Smolska D., Filipowski H., RabczynskiY., Cieslar E. The importance of tubulointerstitial injury in the early of primary glomerular disease. J Intern Med 1998; 243 ( 3) : 215-222.
19. Idasiak Piechocka I, Krzymanski M. The role of tubulointerstitial changes in progression of kidney function failure in patients with chronic glomerulonephritis. Przegl Lek 1996; 53(5): 443-453.
20. Eddy A.A., Giachelli C.M. Renal expression of genes that promote interstitial inflammation and fibrosis in rats with protein-overload proteinuria. Kidney Int 1995; 47: 1546-1557.
21. Леонард Р.А. Гломерулонефриты кошек: современные методы диагностики, лечения и профилактики. Клинико-морфологическое исследование. Челябинск 2010.
22. Razzaque M.S., Taguchi T. Renal fibrosis. Factors that influence and contribute to the regulation of fibrosis. Jn: Contributions to Nephrology. Editors: Razzaque M.S., Taguchi T. 2003; 139: 1-2.
23. Razzaque M.S., Azouz A., Taguchi T. Renal fibrosis. Factors regulating the progression of hypertensive nephrosclerosis. Jn: Contributions to Nephrology. Editors: Razzaque M.S., Taguchi T. 2003: 139: 173-187.
24. Леонард Р.А. Инвазивные методы диагностики нефропатий у кошек. Журнал «Современная ветеринарная медицина». №1, 2012.
25. Böttinger EP, Bitzer M. TGF-beta signaling in renal disease. J Am Soc Nephrol. 2002 Oct;13(10):2600-10.
26. Sedor J.R., Nakazato Y., Konieczkowski M. Interleukin-1 and the mesangial cell. Kidney Int 1992;41:595–599.
27. Buraczynska M., Ksiazek P., Kubit P. et al. Interleukin-1 receptor antagonist gene polymorphism affects the progression of chronic renal failure. Cytokine 2006;36(3–4):167–172.
28. Н.В. Чеботарева, И.Н. Бобкова, Л.В. Козловская, О.А. Ли. Значение нарушений механизмов самозащиты почки при хроническом гломерулонефрите. Журнал «Клиническая нефрология», 1-2011, стр. 8-14.
29. Olszina D.P., Pajkrt D., Lauw F.N. et al. Interleukin-10 inhibits the release of CC chemokines during human endotoxemia. J Infect Dis 2000;181:613–20.
30. Aufricht C., Lu E., Thulin G. et al. ATP releases HSP72 from protein aggregates after renal ischemia. Am J Physiol Renal Physiol 1998;274:268–274.
31. Jorgensen C., Gedon E., Jaquet C. et al. Gastric administration of recombinant 65kDa heat shock protein delays the severi of type II collagen induced arthritis in mice. J Rheumatol 1998;25:763–767.
32. Чеботарева Н. В., Бобкова И. Н., Козловская Л. В. Молекулярные механизмы интерстициального фиброза при прогрессирующих заболеваниях почек (Обзор литературы). Журнал "Нефрология и диализ" Т. 8, 2006 г., №1
33. Sedor J.R., Nakazato Y., Konieczkowski M. Interleukin-1 and the mesangial cell. Kidney Int 1992;41:595–599.
34. Visse R., Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function and biochemistry. Circ Res 2003; 92:827–839.
35. Asadullah K., Sterry W., Volk H.D. Interleukin-10 therapy – review of a new approach. Pharmacol Rev 2003;55:241–269.
36. Fouquerbay B., Boutard V., Phillipe C. et al. Mesangial cell-derived interleukin-10 modulates mesangial cell response to lipipolysaccharide. Am J Pathol 1995; 147:176–182.
37. de Waal Malefyt R., Abrams J. et al. Interleukin-10 inhibits cytokine synthesis by human monocytes: An autoregulatory role of IL-10 produced by monocytes. J Exp Med 1991;174:1209–1220.
38. Olszina D.P., Pajkrt D., Lauw F.N. et al. Interleukin-10 inhibits the release of CC chemokines during human endotoxemia. J Infect Dis 2000;181:613–20.
39. Kuga S., Otsuka T., Niiro H. et al. Supression of superoxide anion production by interleukin-10 is accompanied by a downregulation of the genes for subunit proteins of NADPH oxidase. Exp Hematol 1996; 24:151–57.
40. Fouqueray B., Suberville S., Isaka Y. et al. Reduction of proteinuria in anti- glomerular basement membrane nephritis by interleukin-10 (IL-10) gene transfer. J Am Soc Nephrol 1996;7:1698–1701.
41. Tipping P.G., Kitching A.R., Huang X.R. et al. Immune modulation with interleukin-4 and interleukin-10 prevent crescent formation and glomerular injury in experimental glomerulonephritis. Eur J Immunol 1997;27:530–537.
42. Kitching A.R., Katerelos M., Mudge S.J. et al. Interleukin-10 inhibitsexperimental mesangial proliferative glomerulonephritis. Clin Exp Immunol 2002;128:36–43.
43. Papayianni A., Serhan C.N., Philips M.L. et al. Transcellular biosynthesis of lipoxin A4 during adhesion of platelets and neutrophils in experimental immune complex glomerulonephritis. Kidney Int 1995;47:1295–1302.
44. Claria J., Serhan C.N. Aspirin triggers previously undescribed bioactive eicosanoids by human endothelial cell-leukocyte interaction. Proc Natl Acad Sci USA 1995;92:9475.
45. Conrad D.J., Kuhn H, Mulkins M. et al. Specific inflammatory cytokines regulate the expression of human monocyte 15-lipoxygenase. Proc Natl Acad Sci USA 1992;89:217–221.
46. Brinckmann R., Topp M.S., Zalan I. et al. Regulation of 15-lipoxygenase expression in lung epithelial cells by interleukin-4. Biochem J 1996; 318:305–312.
47. McMahon B., Mitchell S., Brady H.R. et al. Lipoxins: Revelation on resolution. Trends Pharmacol Sci 2001;8:391–395.
48. Colgan S.P., Serhan C.N., Parcos C.A. et al. LipoxinA4 modulates transmigration of human neutrophils across intestinal epithelial monolaeyrs. J Clin Invest 1993; 92:75–82.
49. Ohse T., Ota T., Kieran N. et al. Modulation of interferon-induced genes by lipoxin analogue in anti-glomerular basement membrane nephritis. J Am Soc Nephrol 2004;15:919–927.
50. Godson C., Mitchell S., Harvey K. et al. Cutting edge: Lipoxins rapidly stimulate nonphlogistic phagocytosis of apoptotic neutrophils by monocyte-derived macrophages. J Immunol 2000;164:1663–1667.
51. McMahon B., Mitchell D., Shattock R. et al. Lipoxin, leukotriene and PDGF receptors cross-talk to regulate mesangial cell proliferation. FASEB J 2002;16:1817–1819.
52. Fierro I.M., Kutok J.L., Serhan C.N. Novel lipid mediator regulators of endothelial cell proliferation and migration: Aspirin-triggered-15R-lipoxin A4 and lipoxin A4. J Pharmacol Exp Ther 2002;300:385–392.
53. Katoh T., Takahashi K., DeBoer D.K. et al. Renal hemodynamic actions of lipoxins in rats: A comparative physiological study. Am J Physiol 1992; 263:436–442.
54. Wu S.-H., Liao P.-Y., Yin P.-L. et al. Elevated expression of 15-lipoxigenaseand lipoxin A4 in children with acyte poststreptococcal glomerulonephritis. J Pathol 2009;174:115–122.
55. Boutet P., Bureau F., Dengand G. et al. Inbalance between lipoxin A4 and leukotriene B4 in chronic mastitis-affected cows. J Dairy Sci 2003; 86:3430–3439.
56. Wu S.-H., Liao P.-Y., Yin P.-L. et al. Inverse temporal changes of lipoxin A4 and leukitrienes in children with Henoch-Schonlein purpura. Prostaglandins, Leukotrienes and essential fatty acids 2009;80(4):177–183.
57. Лупинская З.А. Эндотелий сосудов- основной регулятор местного кровотока. Вестник КРСУ / № 7, 2003 г.
58. Brenner В.М. Mechanisms of progression of renal disease. Международный семинар по нефрологии. М.: 1995: 127-134.
59. Brenner B.M., Meyer T.W., Hosteller T.H. Dietary protein intake and the progressive nature of kidney disease: The role of hemody-namically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. NEJM 1982; 307: 652-659.
60. Hostetter T.H., Olson J.L.,Rennke H. et al. Hyperfiltration in remnant nephrons. A potentially adverse response to renal ablation. Am TPhysiol 1981; 241: 85-93.
61. Olson J.L., Urdaneta A.G.,Heptinstall R.H. Glomerular hyalinosis and its relation to hyperfiltration. Lab Invest 1985; 42; 4: 387-398.
62. Томилина Н. А., Багдасарян А. Р. Механизмы нефросклероза и фармакологическая ингибиция внутри почечной ренин-ангиотензиновой системы как основа нефропротективной стратегии при хронических заболеваниях нативных почек и почечного трансплантата (Обзор литературы). Журнал "Нефрология и диализ" Т. 6, 2004 г., №3.
63. El Nahas A.M. Mechanisms of experimental and clinical renal scarring. Jn: Oxford Textbook of Clinical Nephrology ed. Davison, Cameron et al. 1998; 3: 1749-1776.
64. El Nahas A.M. Glomerulosclerosis: intrinsic and extrinsic pathways. Nephrol Dial Transplant 1996; 11: 773-777.
65. Wolf G.,Ziyadeh F.N., Thaiss F. et al. Angiotensin II stimulates expression of the chemokine RANTES in rat glomerular endothelial cells. J Clin Invest 1997; 100: 1047-1058.

|
WWW.VETNEFRO.RU Научно-практическая ассоциация ветеринарных нефрологов и урологов
© Все права защищены 2024г. Использование любых материалов сайта - запрещено!
|