
ВЕТЕРИНАРНЫМ СПЕЦИАЛИСТАМ.
Задать вопрос президенту НАВНУ

Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Сбор анамнеза и физикальные исследования на ранних стадиях течения большинства нефропатий у собак и кошек малоинформативны прежде всего из-за отсутствия каких-либо клинических проявлений, что является следствием колоссальных компенсаторных возможностей почек. Поэтому по возможности более ранняя лабораторная диагностика снижения почечной функции – это одна из приоритетных и вместе с тем наиболее трудноисполнимых задач современной ветеринарной нефрологии.
Самые достоверные сведения об экскреторных возможностях почек и, следовательно, о функциональном состоянии почечной паренхимы в целом дает определение скорости клубочковой фильтрации (СКФ) (29).
Неуклонно снижающаяся или низкая СКФ является наиболее точным маркером наличия у пациента угрожающей жизни нефропатии или хронической болезни почек (ХБП). Точно установлено, что СКФ неуклонно уменьшается у всех пациентов перед развитием ХБП. А сама по себе ХБП обязательно характеризуется снижением СКФ не менее чем на 75% от нормы.
Напрямую измерить СКФ невозможно. Наиболее точные сведения о ней дает определение клиренса вещества, которое не синтезируется в организме, физиологически нейтрально, свободно фильтруется в клубочках и не секретируется, не реабсорбируется и не метаболизируется в канальцах. Поскольку количество этого вещества, внутривенно введенного в организм и профильтрованного в неизменном виде в гломерулах, эквивалентно количеству, выведенному с мочой, то это позволяет точно определить СКФ для почек в целом. На сегодняшний день в качестве «золотого стандарта» для оценки СКФ используется клиренс полисахарида фруктозы инулина.
Однако определение СКФ по клиренсу инулина в ветеринарной медицине имеет целый ряд существенных ограничений, как связанных с техническими сложностями, так и по причине очень высокой стоимости проведения самого теста[1].
В настоящее время в рутинной практике попытка установления СКФ у пациента практически всегда предпринимается с помощью определение уровня креатинина в сыворотке крови. Также на его концентрации основана наиболее широко используемая в ветеринарии классификация степеней ХБП (IRIS). Но связано это не столько с диагностической ценностью креатинина как показателя уровня СКФ, сколько с относительной простотой, доступностью и невысокой стоимостью определения этого лабораторного показателя.
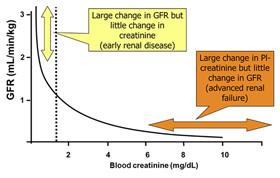
Установление уровня креатининемии – широко распространенный метод лабораторной диагностики (зачастую использующийся вообще как единственный тест для выявления ХБП, а то и вообще любой нефропатии у животных) – дает весьма приблизительное представление не только о СКФ, но и о стадии течения нефропатии в целом. Кроме того, определение уровня креатинина имеет ряд очень серьезных ограничений в верификации тяжести заболевания почек, особенно на ранних и поздних этапах почечного континуума. А нормальные его границы в сыворотке крови далеко не всегда обозначают, что у животного нет угрожающей жизни нефропатии. Именно поэтому 1-я степень ХБП, по классификации IRIS[2] (таблица 1), является неазотемической.
Таблица 1. Классификация степеней ХБП на основании концентрации креатинина в сыворотке крови собак и кошек, по данным сайта www.iris-kidney.com
|
Степени ХБП |
Концентрация креатинина в плазме μmol/l mg/dl |
Комментарии Comments |
|
|
Собаки |
Кошки |
||
|
- |
<125 <1.4 |
<140 <1.6 |
Группа риска по ХБП. Пациенты, попадающие в «группу риска», должны проходить регулярное обследование, и должны предприниматься меры для уменьшения факторов риска. At risk of CKD For patients identified as ‘at risk’ consider regular screening and taking steps to reduce risk factors. |
|
1 |
<125 <1.4 |
<140 <1.6 |
Неазотемическая форма. Любая другая нефропатия, например неадекватная концентрирующая способность почек без явно выявляемой причины, связанной с нефропатией. Выявление отклонений при пальпации и/или при дополнительных инструментальных методах диагностики почек. Устойчивое повышение содержания белка в моче (почечного происхождения). Отклонения при биопсии почек. Прогрессирующееповышениесодержаниякреатининавсыворотке. Non-azotemic Some other renal abnormality present e.g. inadequate concentrating ability without identifiable non-renal cause; abnormal renal palpation and/or abnormal renal imaging findings; persistent proteinuria of renal origin; abnormal renal biopsy results, progressively elevating creatinine levels. |
|
2 |
125 - 179 1.4 - 2.0 |
140 - 249 1.6 - 2.8 |
Легкая ренальная азотемия. Нижний порог этого диапазона лежит в пределах границы диапазона нормы для многих лабораторий. Но нечувствительность к креатинину при проведении скрининг–теста означает, что животные с уровнем креатинина, близким к верхнему пределу нормы, часто имеют проблемы с выделительной системой. Клиническиепризнакилегкойстепенитяжести либоотсутствуют. Mild renal azotemia [lower end of the range lies within the reference range for many labs but the insensitivity of creatinine as a screening test means that animals with creatinine values close to the upper limit of normality often have excretory failure] Clinical signs usually mild or absent. |
|
3 |
180 - 439 2.1 - 5.0 |
250 - 439 2.9 – 5.0 |
Умеренная почечная азотемия. Могут присутствовать многие системные клинические признаки. Moderate renal azotaemia Systemic clinical signs may be present. |
|
4 |
>440 >5.0 |
>440 >5.0 |
Тяжелая ренальная азотемия. Присутствуют клинические признаки системных поражений. Severe renal azotaemia. Systemic clinical signs are usually present. |
Также следует отметить, что свойства креатинина и мочевины как ведущих уремических токсинов, с которыми якобы связано большинство клинических проявлений ХБП, значительно преувеличены. В настоящее время и патофизиологи, и врачи-нефрологи сходятся в мысли о том, что повышение уровня азотемии хотя и может оказывать определенное неблагоприятное влияние на функциональное состояние организма, но все-таки не является ведущим фактором интоксикации, инициирующим целый ряд разнообразных клинических проявлений при ХБП.
Креатинин (как и мочевина) является одним из конечных продуктов азотистого обмена, в норме выделяемых в основном с мочой. Он образуется из белка креатина, служащего источником энергии для скелетной мускулатуры. В них креатин депонируется в виде соединения, носящего название креатинфосфат (креатинфосфорная кислота). При сокращении мышечных волокон креатинфосфат отдает свою энергию, а сам распадается до конечных продуктов – креатинина, воды и остатков фосфора.
Вновь образовавшийся креатинин беспрепятственно проходит через фильтрационный барьер гломерул, но, кроме этого, секретируется и в просвет проксимальных канальцев из перитубулярной микрокапиллярной сети. Поэтому количество креатинина, поступившего в мочу и выведенного из организма у здоровых животных, является суммой профильтрованного и секретированного.
Однако у собак и кошек с ХБП креатинин начинает интенсивно выделяться в просвет кишечника и затем, из-за обильного роста сапрофитной бактериальной флоры (что обычно для больных ХБП), там разрушается. Вследствие этого у пациентов с выраженным снижением функции почек элиминация креатинина из организма более чем на 2/3 может происходить через ЖКТ (что является одной из многих причин, осложняющих оценку уровня почечной функции, рассчитанной только по этому показателю).
Поскольку креатинин образуется в основном в результате биотрансформации креатина в скелетных мышцах, то объем его синтеза прямо пропорционален общей мышечной массе и интенсивности обменных процессов, происходящих в ней. Поэтому среднесуточный объем образования креатинина выше у молодых животных, чем у старых, равно как у ведущих активный образ жизни, чем у страдающих гиподинамией.
Сывороточное содержание креатинина может значительно отличаться у кошек и, особенно, у собак различных пород (нормальные значения этого показателя находятся в диапазоне, превышающем 100 ммоль/л). Кахексия любого генеза, как и низкобелковое питание или тем более анорексия, также может приводить к снижению уровня креатининемии. Высокое содержание в употребляемом животными корме мясных ингредиентов (прежде всего термически обработанных), напротив, может приводить к увеличению уровня азотемии, поскольку часть креатина в процессе приготовления кормов переходит в креатинин.
А уровень мочевины в крови вообще напрямую зависит от количества потребляемого белка и может неоднократно меняться в течение суток. Следовательно, у животных, находящихся на малобелковой диете, уровень азотемии, вероятнее всего, будет ниже, чем это можно было бы предполагать, исходя из данных других лабораторных и визуальных методов диагностики.
К ситуациям или состояниям, которые могут существенно снизить диагностическую ценность определения уровня креатинина, также можно отнести следующие:
Поскольку уровень азотемии, находящийся в пределах нормы, далеко не всегда свидетельствует о том, что у пациента нет угрожающего жизни заболевания почек, то перед назначением нефротоксичных препаратов необходимо оценить функцию почек всеми другими доступными неинвазивными методами (анализ мочи часто может «рассказать» о функции почек гораздо больше, чем анализы крови), а также тщательно взвесить необходимость его проведения.
Из теоретических предпосылок, благодаря которым креатинин широко используется для диагностики почечной недостаточности, можно выделить только две: клиренс креатинина практически идентичен СКФ, рассчитанной по «золотому стандарту» для этого показателя, и скорость выведения креатинина у каждого конкретного животного примерно постоянна во времени. Но и здесь есть очень существенное «но». Фундаментальная физиология говорит о том, что верно это только для пациентов, у которых СКФ снижена не более чем на 25%, т.е. у практически здоровых животных или, во всяком случае, у тех, у которых напрочь отсутствуют какие-либо клинические признаки нефропатии (стоит напомнить и о том, что и животные, и человек могут прекрасно себя чувствовать с одной лишь здоровой почкой, а в этом случае СКФ, само собой разумеется, снижена, по крайней мере, на 50%) (37). Кроме того, скорость экскреции креатинина, относительно постоянная у людей, имеет выраженные внутривидовые различия у мелких домашних животных из-за большого количества разнообразных пород кошек и собак, чей вес может различаться более чем в 100 раз. Поэтому, как это ни странно, решающими факторами при выборе креатинина сыворотки крови в качестве маркера уровня почечной функции оказались следующие:
И только благодаря этому, несмотря на то что уровень креатина сыворотки крови дает очень отдаленное представление о СКФ (а чаще всего не дает вообще никакого) и, следовательно, о почечной функции в целом, именно он (а также мочевина, имеющая еще меньшее диагностическое значение) наиболее часто используется в рутинной практике для диагностики нефропатий и оценки степени их тяжести у мелких домашних животных.
В гуманной медицине существует более 20 предсказывающих формул для вычисления СКФ по уровню креатинина у взрослых и детей, имеющих различные степени смещения и прецизионности[3] относительно результатов ее измерений методами, отнесенными к «золотому стандарту»[4]. Достоверность и, следовательно, клиническая ценность большинства этих предсказывающих формул оказались очень низкими (т.е. расчеты по ним систематически приводили к значительному завышению или занижению СКФ). Но даже те формулы, которые показали относительно высокую степень приближения к истинной СКФ (например,формула Кокрофта-Голта (Cockcroft-Gault), формулы из исследования MDRD[5] и, принадлежащее тем же авторам уравнение CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration equation)(41)), по целому ряду причин не могут быть напрямую инсталлированы на животных.
К основным ограничениям использования концентрации креатинина в сыворотке крови в качестве лабораторного показателя, по которому можно оценить степень снижения почечной функции, можно отнести следующие.
Измерение клиренса эндогенного креатинина как маркера почечной функции у пациента, с теоретической точки зрения, может дать более точные сведения. Но на практике расчет СКФ и по этому показателю далеко не всегда эквивалентен расчету по «золотому стандарту». Кроме того 24-часовое измерение клиренса креатинина является непростой задачей, поскольку, кроме прочего, требует сбора суточного объема мочи, что уже само по себе закладывает большой процент ошибки. Да и сам клиренс креатинина значимо варьируется день ото дня, приводя к серьезным разночтениям даже при корректном суточном сборе мочи. Следует помнить и о том, что чем тяжелее степень ХБП, тем больше креатинина элиминируется из организма не только с мочой, но и через ЖКТ.
В добавление к этому следует отметить, что отсутствуют данные о нормальном уровне креатинина у кошек старше 10-15 лет и у собак 7-9 летнего возраста. В то время как у пожилых пациентов в силу чисто физиологических процессов, как «старение почек» в частности, так и всего организма в целом, уровень креатининемии часто не коррелирует с данными других неинвазивных и инвазивных методов диагностики. Так, например, у животных с вторично сморщенной почкой, тяжелой гипертензией и выраженным нефритическим синдромом азотемия может находиться в пределах нормы или даже быть ниже ее.
Стадии течения хронических нефропатий и характерный для них уровень креатининемии приведены в таблице 2
Также нужно учитывать, что мочевина не используется в качестве переменных в предсказывающих формулах для определения СКФ и на ее уровне не построена ни одна из существующих классификаций степеней ХПН или ХБП ни у животных, ни у человека. Это говорит о еще меньшем диагностическом значении этого биохимического показателя, даже в сравнении с креатинином.
Длительное время считалось, что креатинин и мочевина являются не только маркерами почечной недостаточности, но и вызывают большинство ее клинических проявлений. Однако в настоящее время эти взгляды на патогенез ХПН и ХБП пересматриваются. Прежде всего небезынтересен тот факт, что у собак и кошек с повышенными уровнями креатинина и мочевины могут отсутствовать какие-либо клинические проявления. Да и длительное экзогенное введение больших доз этих веществ здоровым животным не приводит к появлению у них признаков ХБП.
Сегодня многие авторы склоняются к тому, что наиболее значимыми факторами т.н. уремической интоксикации (т.е. симптомокомплекса, возникающего на поздних стадиях почечного континуума) являются прежде всего нарушение кальций-фосфорного баланса в организме и развивающийся на его фоне гиперпаратиреоз. И именно паратиреоидному гормону, имеющему рецепторы не только первого типа на остеобластах, но и второго во многих других органах и тканях, отводится ключевое место в развитии целого ряда осложнений ХБП, во всяком случае, на ранних и средних этапах ее течения[6]. На заключительной стадии ХБП (уремическая, терминальная или IVпо классификации IRIS) состояние многократно усугубляется еще и нарушением кислотно-щелочного равновесия в организме (ацидозом, например). На этом фоне накопление конечных продуктов азотистого обмена веществ хотя, возможно, и имеет определенное токсическое влияние, но вряд ли является превалирующим.
В развитии азотемии далеко не всегда «виновными» оказываются непосредственно почки (хотя рано или поздно при отсутствии адекватных лечебных мероприятий этот парный орган оказывается втянут в патогенез любой патологии, характеризующейся гиперазотемией).
Преренальная азотемия (гиповолемического, гипотензивного и т.п. характера), как правило, имеет яркие клинические проявления или, во всяком случае, может быть теоретически предсказана (например, ее развитие можно предположить перед проведением длительной хирургической операции или после массивной кровопотери). С постренальной азотемией дела обстоят несколько сложнее. Разумеется, острая задержка мочи, возникшая в результате обструкции уретры, также не представляет сложности в диагностике. Но вот разрывы мочевого пузыря и, особенно, мочеточников могут остаться незамеченными и требуют, в частности, проведения визуализирующих методов диагностики. Тем более что первые клинические признаки ХПН при этом начинают появляться только тогда, когда уровень креатинина становится выше 440-600 ммоль/л. Последнее, между прочим, является дополнительным доказательством того, что значение азотемии в патогенезе т.н. уремической интоксикации и ХБП значительно преувеличены.
Креатинин сыворотки крови сегодня очень широко используется для диагностики различных нефропатий, а также для классификации стадий ХБП у собак и кошек. Однако в подавляющем большинстве случаев этот показатель не является сколько-нибудь точным эквивалентом СКФ (ни сам по себе, даже в случае расчета его суточного клиренса, ни как переменная в предсказывающих формулах) и, следовательно, не может отражать истинный уровень почечной функции в целом. Поэтому для выявления нефропатий и оценки тяжести их течения необходимо прибегать к возможно более широкому спектру неинвазивных, а при необходимости и инвазивных, методов исследования (равно как и к статистической информации о распространенности тех или иных нефропатий в конкретном регионе, полученной в результате обработки данных гистоморфологических исследований аутопсийного материала) для того, чтобы диагностировать патологию на возможно более раннем этапе, т.е. тогда, когда еще возможно эффективное этиологическое и/или патогенетическое ее лечение и есть вероятность на годы отдалить появление первых клинических признаков ХБП.
К грубой врачебной ошибке можно отнести ситуацию, при которой нефропатии диагностируются только тогда, когда у пациента начинает увеличиваться уровень азотемии (тем более что рассчитанная по уровню креатинина и/или мочевины СКФ, а следовательно, и уровень почечной функции в целом систематически и значительно завышаются). Связано это с тем, что на азотемическом этапе почечного континуума большая часть форменных элементов и стромы почек уже находится в состоянии полной или частичной деструкции (склерозирование и т.д.). И такой подход позволяет начать лечение заболеваний почек только тогда, когда возможна лишь симптоматическая и/или заместительная терапия, а качество жизни и пациента, и его владельцев стремительно и неуклонно снижается не смотря на проводимые лечебные мероприятия.
[1] Определения СКФ по клиренсу таких экзогенных радиоактивных меток, как 125I-иоталамат и 99mTc-DTPA, хотя также представляет собой высокоточные методы измерения этого показателя, но в настоящее время еще менее доступны, чем тест с инулином. А определение СКФ по плазменным клиренсам таких веществ, как iohexol и 51Cr-EDTA , кроме прочего требуют вычисления точной площади поверхности тела пациента, что далеко не всегда возможно в ветеринарной медицине.
[2] www.iris-kidney.com
[3] От англ. precision — точность.
[4] В различных клинических исследованиях в гуманной медицине проводилась сравнительная оценка уровня почечной функции по предсказывающей формуле, одной из переменных в которой был уровень креатинина сыворотки, а полученные результаты у тех же самых пациентов затем сравнивались со СКФ, определенной при помощи методов, соотнесенных к «золотому стандарту».
[5]Modification of Diet in Renal Disease Study (Levey AS исоавт., 1999).
[6] Паратиреоидному гормону сегодня также отводится ведущая роль в развитии такого осложнения ХБП, как миокардиопатии(38,39).

|
WWW.VETNEFRO.RU Научно-практическая ассоциация ветеринарных нефрологов и урологов
© Все права защищены 2026г. Использование любых материалов сайта - запрещено!
|